本ページは、国立がん研究センター中央病院からの委託による医師主導臨床試験の広告となります。なお、臨床試験は日本臨床腫瘍研究グループ(JCOG)が実施しています。また、臨床試験を実施する実施医療機関の審査・承認を受けたものを掲載しています。
本ページは、「手術後の小腸腺がん患者を対象とした術後化学療法に関する医師主導臨床試験」への応募ページとなります。臨床試験への参加をご希望される方は、参加応募フォームからまたはお電話にてお申込みください。

【お問い合わせ電話番号】
Webサイト『オンコロ』:0120-974-268 (平日:10:00~18:30)
メールアドレス:info_oncolo@3h-ct.co.jp
臨床試験の概要
臨床試験の目的について
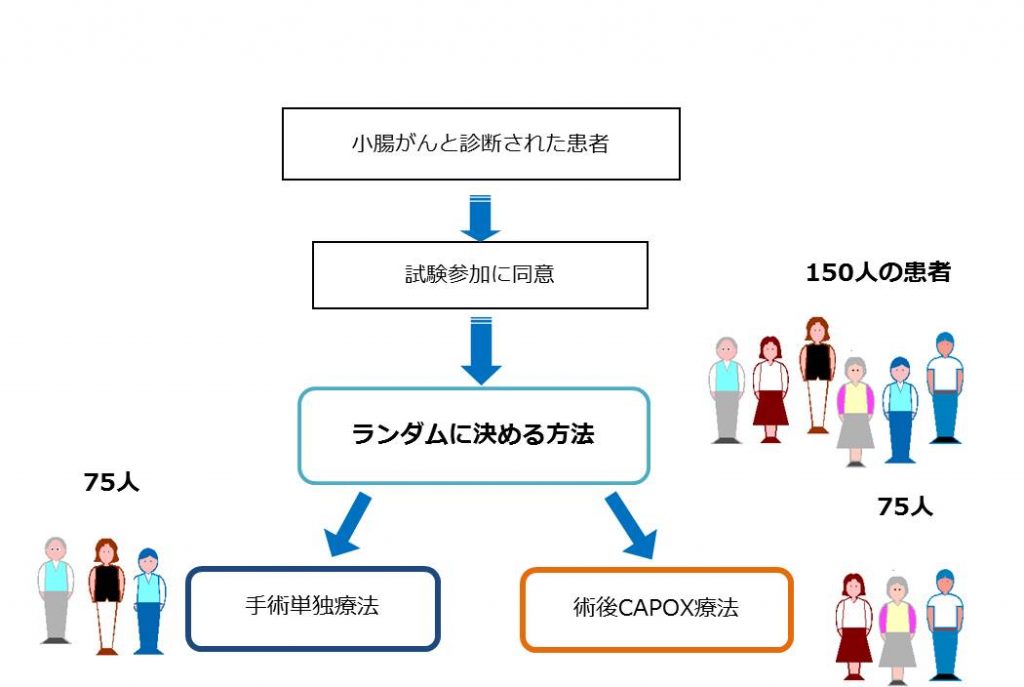
この臨床試験は「小腸腺がん」と診断され、手術を受け、目に見えるがんが取り切れたと判断されている患者が対象に、「術後化学療法としてカペシタビンとオキサリプラチン併用療法を受けた場合(CAPOX;カポックス療法)」と「無治療にて経過観察の場合(手術単独療法)」を比較検討することを目的としています。
この臨床試験には計115人の患者に参加頂き、1対1の割合で手術単独療法または術後CAPOX療法を実施することになります。
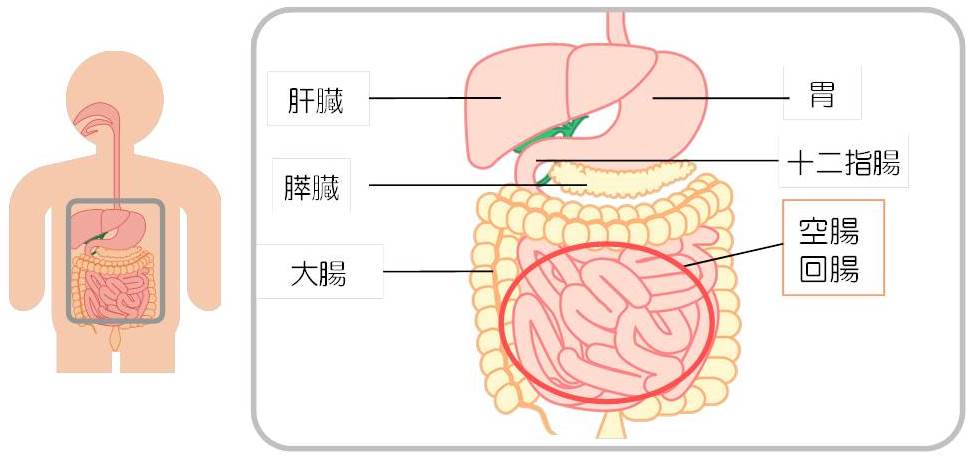
なお、小腸腺がんとは、十二指腸腺がん(ファーター乳頭部がんを除く)、空腸腺がん、回腸腺がんをさします。
小腸腺がんの術後化学療法の現状とこの臨床試験の意義
がんに対する治療法には、手術とあわせて、再発予防を目的とした抗がん剤による治療(化学療法)を行うことがあります。しかし、小腸腺がんについては、手術後の化学療法による再発予防効果がどのくらいあるのかはまだ不明です。そのため、これまでのところ、手術で取り除くことができる小腸腺がんに対する標準治療※1は、手術のみの治療(手術単独療法)です。
これまでの報告によると、小腸腺がんの状態の患者が手術を受けた場合、手術をした日から5年後に生存されている方はステージ1の場合およそ5~6割、ステージ2の場合およそ4~5割、ステージ3の場合およそ2~3割であるといわれています。
胃がんや大腸がんでは、手術後に抗がん剤治療を行うほうが手術のみで治療を終える場合に比べ、がんの再発を抑えられることがわかっています。このような、手術後に行う抗がん剤治療のことを「術後化学療法」と呼びます。同様に小腸腺がんでも、再発を予防する術後化学療法の開発が必要であると考えられています。
しかし、小腸腺がんには有効な抗がん剤の選択肢が乏しく、また、稀ながんであることから、大規模な臨床試験によって効果を確かめることが難しいため、現在のところ、保険適用されている抗がん剤はなく、最適な化学療法も確立していません。
このような中、国内外の医療機関では、探索的に転移性小腸腺がんへの化学療法の検討が行われており、少しずつですが、研究結果が報告されつつあります。これらの研究結果のうち、大腸がんの治療にも用いられる「カペシタビン」と「オキサリプラチン」という2種類の抗がん剤を組み合わせる「CAPOX療法」が、転移性小腸腺がんに有効であることが分かってきており、再発予防を目的とした術後化学療法としても治療効果が期待されています。
しかし、CAPOX療法は、下痢、吐き気、アレルギー反応などの副作用があることが知られています。また、小腸腺がんの再発予防効果は不明であり、手術単独療法と比べて、本当に効果があるのかどうかも明らかではありません。
そこで今回、手術単独療法よりも、手術後に術後化学療法としてCAPOX療法を行うほうが優れているかどうかを調べるための臨床試験を計画しました。
※1 標準治療とは、現在までに効果が科学的に証明されている治療法や、臨床試験によって得られた証拠に基づいて行われる治療を指します。または、他の治療よりもよいと考えられ、これまで広く行われてきた治療を指すこともあります。
※2 これらの数字はこれまでの研究の結果の一つを示しております。個々の患者の余命を正確に予測することは現在の医学では不可能です。
臨床試験に関するQ&A
Q:どのような方が対象となりますか?
本試験の対象になる方は以下の通りです。
・16歳以上74歳以下の方
・小腸腺がん(十二指腸腺がん、空腸線がん、回腸腺がん)と診断され、手術でがんが完全切除されている方
・(術後の)ステージ1~3の方
・他臓器への転移がないことが確認されている方
・これまでに化学療法(抗がん剤治療)や放射線療法を受けたことがない方
・手術後84日以内の方
Q:スケジュールを教えてください。
この臨床試験に参加した場合、以下の2つの治療に1対1の割合でランダムに割り付けられます。
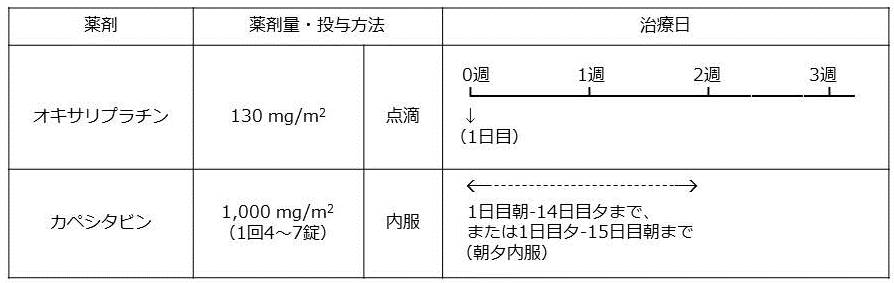
①カペシタビンとオキサリプラチン併用療法(術後CAPOX療法)
1コース3週間として8コース(計24週間)行います。
②経過観察(手術単独療法)
手術後に抗がん剤の治療は行わず、定期的に経過観察のみとなります。
Q:通常の治療とは違いがありますか?
小腸腺がんには有効な抗がん剤の選択肢が乏しく、また、稀ながんであることから、大規模な臨床試験によって効果を確かめることが難しいため、現在のところ、保険適用されている抗がん剤はなく、最適な術後化学療法も確立していません。よって、この臨床試験に参加しない場合は、術後の経過観察が標準となります。
なお、この臨床試験で行われるCAPOX療法は、小腸腺がんの術後化学療法の薬として承認が得られていないため、国内の医療機関では保険診療として受けることはできません。その他、CAPOX療法以外の抗がん剤治療を受ける場合にも、保険診療として受けることはできません。
Q:治療への費用負担はどのようになりますか?
この臨床試験に参加している間のCAPOX療法(カペシタビンとオキサリオプラチン)の薬剤は、製薬企業から無償提供を受けるため、薬剤に関する費用負担はありません。ただし、CAPOX療法の際に発生する人件費、材料費に関しては、保険が適用されず全額を自己負担していただくこととなります(医療機関によって異なりますが、24週間で約25000円程度)。また、治療中に定期的に実施する採血検査、CT/MRIといった画像検査、CAPOX療法の副作用に対する治療が必要となった場合は、通常の診療と同様に保険が適用され自己負担分の費用を負担していただくこととなります。これらの費用の詳細は担当医にお尋ねください。本臨床試験は先進医療B制度下での実施が許可されているため、上記の混合診療が認められています。
Q:どこでこの臨床試験が実施されていますか?
この臨床試験は以下の医療機関で実施されています。
北海道大学病院
東北大学病院
栃木県立がんセンター
埼玉県立がんセンター
国立がん研究センター東病院
国立がん研究センター中央病院
杏林大学医学部付属病院
神奈川県立病院機構神奈川県立がんセンター
東海大学医学部附属病院
新潟県立がんセンター新潟病院
金沢大学医学部附属病院
静岡県立静岡がんセンター
愛知県がんセンター中央病院
大阪国際がんセンター
国立病院機構大阪医療センター
大阪医科大学
県立広島病院
国立病院機構四国がんセンター
高知医療センター
国立病院機構九州がんセンター
熊本大学医学部附属病院
大分大学医学部附属病院
※患者関係者からの直接の問い合わせはご遠慮ください。臨床試験参加の可能性があっても、参加できない場合があります。
Q:もっと詳しい情報が知りたいです。
本試験は以下にて公開されています。ご参照ください。
臨床研究実施計画番号:jRCTs031180008
また、JCOGのホームページ上でも公開されています。
http://www.jcog.jp/document/1502C.pdf
*参加を希望される場合、上記のリンク先の問い合わせ先に連絡するのではなく、本ページ上の電話番号にご連絡ください。
この臨床試験に関する問い合わせ先
本臨床試験に興味を持たれた方、疑問点がある方、参加希望の方は以下にお問い合わせ下さい。
電話番号;0120-974-268(平日:10:00~18:30)
メールアドレス:info_oncolo@3h-ct.co.jp
その他、インターネットでの申し込みは以下よりお申し込みください。
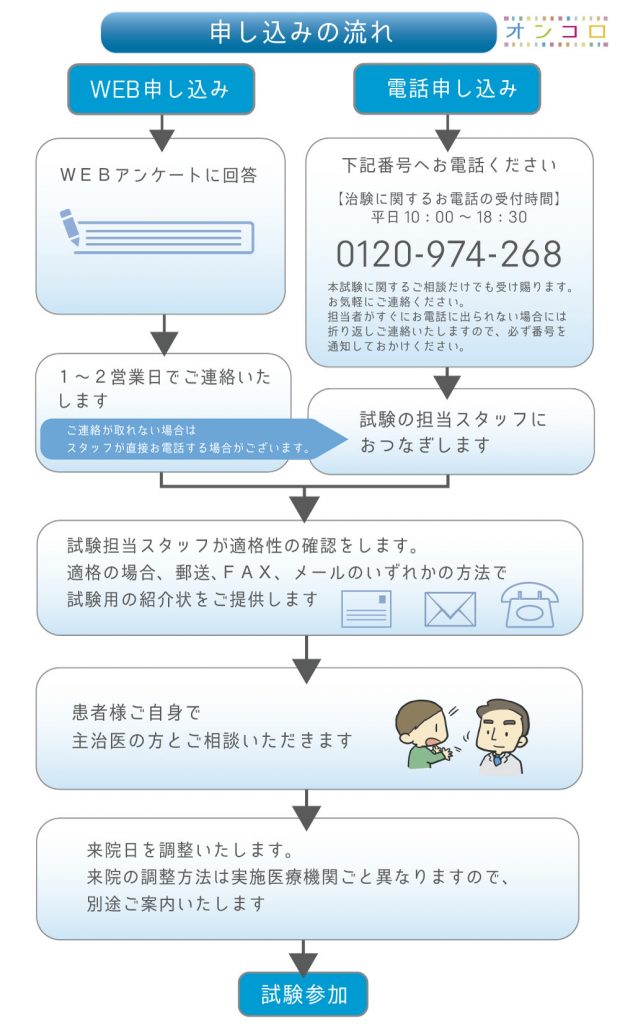
臨床試験への参加の流れ
プライバシーポリシーについて
あなたのプライバシーは保護され、あなたの許可するもしくは法律で必要とされる場合を除き、提供された情報は当該臨床試験に関わる人のみが共有します。ご提供いただいた個人情報が外部会社に売却されたり、直接の同意なしに保存・収集されたりすることはありません。あなたの個人情報は、臨床試験参加中および参加後も保護され、いつ臨床試験への参加中止を決定したか否かを問いません。
臨床試験について
ヒトを対象とする研究分野のことを臨床研究といいます。臨床研究の中でも、ヒトに実際に治療法を用いて実施するものを臨床試験といいます。
監修:国立がん研究センター中央病院 消化管内科 本間 義崇