臨床研究 / 臨床試験 / 治験
臨床研究について
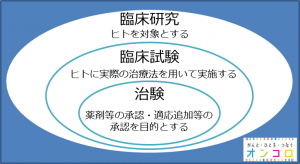
臨床研究とはヒトを対象とする研究分野のことです。
臨床研究の中でも、ヒトに実際に治療法を用いて実施するものを臨床試験といいます。中でも、承認されていない薬剤等を、承認を目的としてデータを集める過程等を治験といいます。
臨床試験について
臨床試験とは、がんまたはその他疾患の新たな治療法について検証するヒトを対象とした試験のことです。既に使用できる薬剤や治療法等、開発中の薬剤や治療法等が安全に使用でき、健康状態を改善する効果があるかどうかを確認します。臨床試験は、第1相から第3相試験に大別されます。

治験について
治験とは、承認されていない薬剤等を、承認を目的としてデータを集める過程等を治験といいます。
薬が世に出るためには、国(厚生労働省)から薬の使用についての承認を得る必要があります。
そのためにまず、動物で効果や安全性について詳しく調べられます。その後、患者さんに参加していただいて、承認前の薬の有効性や安全性を調べたり、既に承認済みの薬について新たな適応症や用法・用量の有効性や安全性を調べます。
このように人での効果や安全性を確認する試験を「治験」といい、治験に用いられる薬を「治験薬」(再生医療製品等であれば「治験製品」)といいます。ここで有効性と安全性が確かめられてはじめて「薬」や「医療製品」として世に出ることになります。
治験は適切な基準(GCP)にしたがって行うことが義務づけられています。また、治験には研究的な側面があり、綿密な計画に基づいて専門の医師が細心の注意を払いながら薬の効果と安全性について調べます。
治験は、第1相から第3相に大別されており、通常は第3相試験の結果を以って、厚生労働省に承認申請しますが、「抗がん剤」や「希少疾患」などの場合、第2相試験データのみので申請することがあります。また、海外の第3相試験の有効性結果と少人数の日本人を対象とした第1/2相試験の結果を用いて申請するケースもあります。この場合、日本で行われた第1/2相試験のことをブリッジングスタディ(橋渡し試験)といいます。
国が、治験で得られた結果を厳密に審査して医薬品として承認すると、同じ病気で苦しむ患者さんにはじめて使えるようになります。
私たちが現在使用している薬や治療法は、多くの方のご協力を経て誕生したものであり、病気の治療方法が進歩するためには不可欠なものです。