目次
- 1非小細胞肺がんの新薬サイラムザ(ラムシルマブ)とは
- 2サイラムザ(ラムシルマブ)の薬剤概要
- 2-1
- 2-2
- 2-3
- 2-4
- 2-5
- 2-6
- 3サイラムザ(ラムシルマブ)の作用機序
- 4サイラムザ(ラムシルマブ)の最新情報
- 4-1
- 4-2
- 4-3
- 5サイラムザ(ラムシルマブ)の口コミ
- 5-1
- 5-2
- 6サイラムザ(ラムシルマブ)の治験情報
- 6-1
- 6-2
- 6-3
非小細胞肺がんの新薬サイラムザ(ラムシルマブ)とは
非小細胞肺がんの新薬としては抗PD-1抗体薬のオプジーボ(ニボルマブ)、キイトルーダ(ペムブロリズマブ)、抗PD-L1抗体薬のテセントリク(アテゾリズマブ)、バベンチオ(アベルマブ)、デュルバルマブの5製品が期待されています。 たしかに、これら抗PD-1/PD-L1抗体薬は非小細胞肺がんのゴールデンスタンダードであった既存の治療方法の成績よりも勝り、2016年12月に改定された肺がん診療ガイドラインでもキイトルーダがPD-L1発現率50%以上のステージⅣ非小細胞肺がん患者の一次治療として最も推奨される薬剤として位置づけられています。 しかし、抗PD-1/PD-L1抗体薬がゴールデンスタンダードとなるのは非小細胞肺がんの中でもPD-L1発現率の高い患者に限り、EGFR遺伝子変異陽性、ALK遺伝子転座陽性の患者に対して抗PD-1/PD-L1抗体薬は推奨されておりません。 そのため、EGFR、ALKなど遺伝子変異を有する患者に対しては抗PD-1/PD-L1抗体薬以外の新しい治療方法を開発する必要があります。そして、この新しい治療方法として期待されていますのが サイラムザ(ラムシルマブ) です。サイラムザはEGFR遺伝子変異陽性非小細胞肺がんのゴールデンスタンダードであるタルセバと併用することで、その有効性がタルセバ単剤療法よりも上回ることが期待されています。 なぜなら、サイラムザと同じ作用機序である抗VEGF(血管内皮細胞増殖因子)抗体薬であるアバスチンは、既にタルセバとの併用療法でその有効性がタルセバ単剤療法を勝ることが証明されているからです。サイラムザ(ラムシルマブ)の薬剤概要
製品名
サイラムザ一般名
ラムシルマブ(ramucirumab)用法用量
ラムシルマブとして3週間に1回10mg/kgを約60分かけて点滴静注する効能効果
未定(切除不能な進行・再発の非小細胞肺がん)主な副作用
未定(好中球減少症、口内炎、鼻出血、末梢性浮腫、発熱性好中球減少症)製造承認日
2015年6月(治癒切除不能な進行・再発の胃がん)サイラムザ(ラムシルマブ)の作用機序
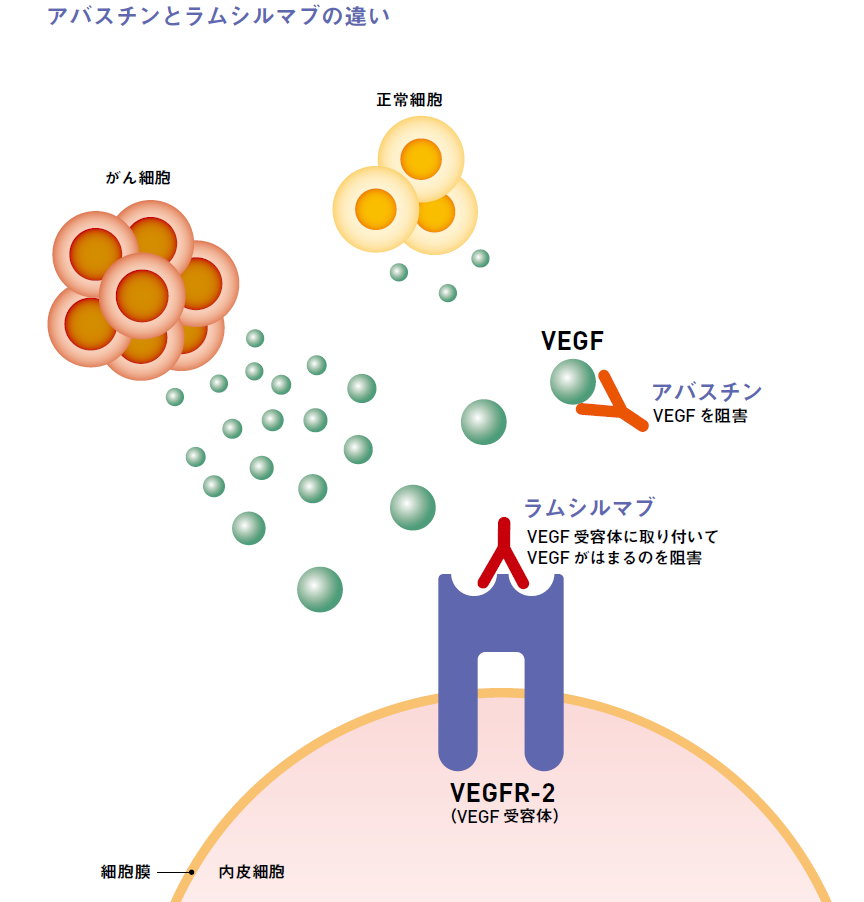
ロハス・メディカル
サイラムザはヒトVEGFR-2に対する特異的抗体であり、VEGFリガンド(VEGF-A、VEGF-C、VEGF-D)のVEGFR-2への結合を阻害することで、VEGFR-2の活性化を阻害し、内皮細胞の増殖、遊走及び生存を阻害し、腫瘍血管新生を阻害します。サイラムザ(ラムシルマブ)の最新情報
1)Ramucirumab plus docetaxel versus placebo plus docetaxel for second-line treatment of stage IV non-small-cell lung cancer after disease progression on platinum-based therapy (REVEL): a multicentre, double-blind, randomised phase 3 trial
概要
プラチナベースの化学療法治療後に増悪したステージⅣ非小細胞肺がん患者の二次治療としてサイラムザ+ドセタキセル併用療法、又はドセタキセル単剤療法群を投与しPFS(無増悪生存期間)、OS(全生存期間)を比較検証した試験出典
The Lancet配信日
2014年8月サイラムザ(ラムシルマブ)の口コミ
医師のコメント
非小細胞肺がん ラムシルマブ(サイラムザ)が日本人対象の2次治療に有効性示す LungCancer https://t.co/N7k7nD6XeM
— イズミ ノリコ (@shnizumi) 2016年9月12日
Tom Powels discusses the pembrolizumab plus ramucirumab early phase lung data at ESMO. @YaleCancer @myESMO @LillyPad pic.twitter.com/kNPREt6YVH
— Roy Herbst (@DrRoyHerbstYale) 2016年10月10日
Bevacizumab, ramucirumab, nintedanib: 3 anti-angiogenics that improve outcomes combined to taxanes in 2L NSCLC. Strong signal. #asco16 #lcsm
— Dr. Antonio Calles (@Tony_Calles) 2016年6月6日
その他医療関係者のコメント
医薬品第二部会。サイラムザ(ラムシルマブ)の非小細胞肺がんの適応追加が通過。2015年6月の胃がんでの販売開始から16年5月の大腸がんの追加に続き3つ目の適応。ドセタキセルと併用し3週に1回、1回10㎎/kg(体重)を点滴静注。薬価は100㎎が7万5千円、500㎎が35万5千円。
— 国際医薬品情報 (@IPI_editors) 2016年5月30日
Phase I trial of ramucirumab plus pembrolizumab shows promise in NSCLC, @DrRoyHerbstYale presents #ESMO16 #lcsm https://t.co/LtugjuxXTB
— Yale Cancer Center (@YaleCancer) 2016年10月10日
News: NICE doesn't recommend ramucirumab + docetaxel for adv./metastatic #NSCLC after prog. on Pt-based chemotherapy https://t.co/5lopZaM6M0
— The Lancet Oncology (@TheLancetOncol) 2016年8月25日








 病院の詳細検索
病院の詳細検索
 オンコロとは
オンコロとは
 メディカル・サポーター
メディカル・サポーター
 Remember Girl’s Power!!
Remember Girl’s Power!!
 0120-974-268
0120-974-268