目次
PD-L1高発現の転移性非小細胞肺癌の未治療患者を対象としたMK-3475とプラチナ製剤併用化学療法を比較する無作為化非盲検第III相試験(Keynote024)
| 対象がん腫 | 非小細胞肺がん |
| フェーズ | P3 |
| 実施期間 | 2014年8月~2016年6月 |
| 実施国 | 日本、アメリカ、オーストリア、オーストリア、ベルギー カナダ、フランス、ハンガリー、アイルランド、イスラエル イタリア、オランダ、ニュージーランド、スペイン、イギリス |
| 目標症例 | 300 |
| 状況 | 募集中 |
| 手法 | 無作為化、非盲検、実薬対照試験 |
| 被験薬名 | MK-3475(一般名:ペンブロリズマブ、商品名:-----) |
| 種類 | 免疫チェックポイント阻害薬(抗PD-1抗体) |
| 投与経路 | 静脈内投与 |
試験概要
<専門的な説明>
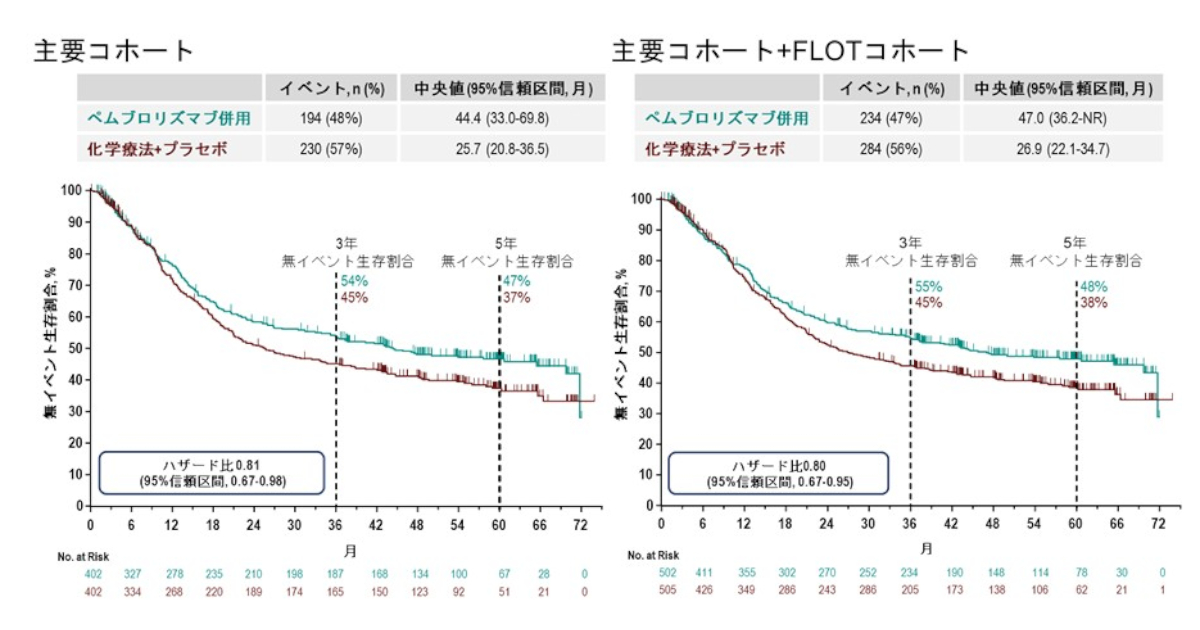
本試験はPD-L1高発現でかつIV期の転移性非小細胞肺癌の未治療患者を対象としたMK3475とプラチナ製剤併用標準化学療法を比較した有効性及び安全性を評価する試験である。 本試験の主要仮説はPD-L1高発現の転移性非小細胞肺癌患者においてプラチナ製剤化学療法よりもMK3475がRECIST1.1による無増悪生存期間を有意に延長させることである。<一般的な説明>
がん細胞上にPD-L1というタンパク質が高発現(多く存在)しているステージ4の転移の認められる非小細胞肺がん患者さんのうち、治療を行っていない方を対象にペンブロリズマブとプラチナ製剤(商品名:パラプラチン、ブリプラチンなど)を使用した標準化学療法(通常、治療されるであろう薬剤治療)の有効性と安全性を比較する試験です。 この試験はPD-L1が高発現している転移性の非小細胞肺がんの患者に対してはプラチナ製剤を使用した化学療法よりもペンブロリズマブの方が腫瘍の進行を抑える期間が長いという仮定のもとに実施します。治験薬剤の説明
<専門的な説明>
A humanized monoclonal IgG4 antibody directed against human cell surface receptor PD-1 (programmed death-1 or programmed cell death-1) with potential immunopotentiating activity. Upon administration, pembrolizumab binds to PD-1, an inhibitory signaling receptor expressed on the surface of activated T cells, and blocks the binding to and activation of PD-1 by its ligands, which results in the activation of T-cell-mediated immune responses against tumor cells. The ligands for PD-1 include PD-L1, which is expressed on antigen presenting cells (APCs) and overexpressed on certain cancer cells, and PD-L2, which is primarily expressed on APCs. Activated PD-1 negatively regulates T-cell activation through the suppression of the PI3K/Akt pathway. Check for active clinical trials or closed clinical trials using this agent. (NCI Thesaurus) (National cancer institute drug dictionaryより:http://www.cancer.gov/publications/dictionaries/cancer-drug?CdrID=695789)<一般的な説明>
通常、細菌等の異物が体内に認められたときに免疫細胞が攻撃します。一方、がん細胞は免疫細胞から異物と認められないような機能を有しますが、その時にPD-1やPD-L1というたんぱく質がかかわっています。MK3475はその機能を無効にできると期待されています。結果、がん細胞を異物であると認識することができるようになります。がん細胞を異物と認識できるようになると、免疫細胞ががん細胞を攻撃できるようになります。主な参加条件等
この試験の対象となりうる方
- 18歳以上の方
- 多臓器へ転移を有するステージ4非小細胞性肺がんの方で薬剤治療を行っていない方
- ステージ4と診断された後に、放射線治療を受けていない腫瘍組織から採取した腫瘍組織検体を提出できる方
- PD-L1高発現が確認された方
- EGFR遺伝子及びEML4/ALK遺伝子に異常が認められない方
- ECOG PSが0~1の方
この試験の対象とならない方
- 症候性の中枢神経系への転移又はがん性髄膜炎を合併している方。
- 本人又は本人の家族(配偶者又は子供)が本治験に直接関わりがある治験実施医療機関又は治験依頼者のスタッフである方








 病院の詳細検索
病院の詳細検索
 マイページ
マイページ
 オンコロとは
オンコロとは
 メディカル・サポーター
メディカル・サポーター
 Remember Girl’s Power!!
Remember Girl’s Power!!
 0120-974-268
0120-974-268